RUNX3
암억제유전자 RUNX3
1. 암억제 유전자 RUNX3의 발견
암 억제 유전자(tumor suppressor)란 말 그대로, 이들이 세포내에서 정상적으로 활동하고 있는 경우, 담배연기나 자외선, 유전자 변이 등 유해 요소에 의해 잘못된 세포를 복구하거나 세포자살(apoptosis)로 유도하여 암이 발생하지 않도록 함으로써 우리 몸을 암으로부터 지켜주는 ‘우리 몸의 암 지킴이’라 할 수 있습니다. 기존에 알려진 암 억제 유전자로 p53이라는 유전자가 있으며, 셀가디언의 설립자인 충북대학교 의과대학 배석철 교수가 RUNX3라는 새로운 암 억제 유전자를 발견하였고, 우리나라의 위암 환자의 많은 비율에서 이 유전자가 불활성화, 즉 정상적으로 발현되지 못하고 있음을 발견하였습니다. (Li et al., Cell, 2002, 109(1), 113-124, Causal relationship between the loss of RUNX3 expression and gastric cancer; Balmain A. Nature. 2002, 417: 235-7, Cancer: new-age tumor suppressors) 최근의 연구 결과는 다음 10종의 암 환자의 약 58%에서 이 RUNX3 암 억제 유전자가 불활성화되어 있음을 확인해주고 있습니다. (Chuang et al., Int. J. Cancer. 2013, 132(6): 1260-71, RUNX family: Regulation and diversification of roles through interacting proteins)
RUNX3 불활성화 비율 (%)
주식회사 셀가디언은 대학 내 벤처기업입니다. 암 억제 유전자인 RUNX3의 발견을 기반으로, 의, 치, 약학대학 연구자들이 모여 부작용 없는 항암(보조)제를 개발하기 위하여 2001년 11월 (주)셀가디언을 설립하였습니다.
환자와 의료진, 연구자 등 암과 성실하게 싸우는 사람들이 궁극적으로 찾고 싶은 것은 다음의 조건들을 가지고 있는 약물일 것입니다.
1) 효과 있는 약 (암세포를 억제하는 약)
2) 부작용 없는 약 (정상세포에는 무해한 약)
그러나 위의 두 가지 조건을 모두 갖추고 있는 ‘제대로 된 항암제’는 아직 찾아보기 어렵습니다. 그래서 효과가 조금이라도 있으면 다소의 부작용을 감수하고라도 힘든 치료 과정을 감당할 수밖에 없는 것이 현재 우리의 현실입니다.
2. 암억제 유전자의 활성화 – 니코틴산아미드의 발견
따라서 불활성화된 암 억제 유전자를 다시 활성화시킬 수 있다면, 우리 몸의 암 지킴이가 다시 작동하여 암세포의 성장을 억제하고, 암세포의 세포자살을 유도함으로써 암을 이겨낼 수 있을 것으로 기대됩니다. 셀가디언의 연구자들은 이 점에 착안하여 불활성화된 RUNX3를 다시 활성화할 수 있는 약물을 찾고자 하였습니다.
어떤 단백질이나 수용체를 억제하는, 즉 작동하지 못하도록 하는 물질을 찾기는 비교적 쉽습니다. 하지만 능력을 잃어버린 단백질에 직접 작용하여 다시 활성화하는 물질을 찾는 것은 너무나 어려운 일입니다.
따라서 우리 몸에서 RUNX3의 활성을 억제하는 효소를 찾아, 그 효소를 억제함으로써 결과적으로 RUNX3의 활성을 되찾는 방법으로 연구의 방향을 설정하고 그러한 물질을 찾기 위해 연구해 왔습니다.
수년의 연구 결과 몇 개의 물질을 찾았습니다. 그러나 니코틴산아미드 외의 다른 물질들은 독성이 커서 인체에 적용하기 어려웠고, 셀가디언의 연구자들은 유효 투여량에서 독성은 물론 부작용이 전혀 보이지 않는 니코틴산아미드를 후보 물질로 선정하였습니다. 니코틴과 니코틴산아미드는 다릅니다.
니코틴은 담배에 포함되어 있는 독성 물질이며, 니코틴산(나이아신)과 니코틴산아미드(나이아신아마이드)는 체내 에너지 생성에 필요한 영양소로서 비타민 B3입니다. 체내에서 니코틴과 니코틴산아미드는 상호 전환될 수 없는 전혀 별개의 물질입니다. 니코틴산아미드는 수용성 비타민의 하나입니다.
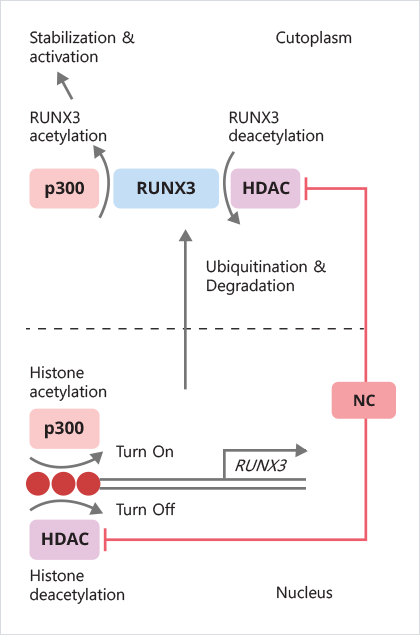
하지만 보통의 비타민제에 들어있는 일반적인 용량으로는 RUNX3 활성화 효과가 나타나지 않으며, 고용량으로 투여하면 class III HDAC(탈아세틸화 효소의 하나)의 기능을 억제함으로써 p300(아세틸화 효소의 하나)의 기능을 활성화시킵니다. 이 p300(아세틸화 효소)은 다시 불활성화된 RUNX3를 활성화하며, 결과적으로 RUNX3의 암 억제 기능을 회복시키게 됩니다.
(Kim et al. J Urol. 2011. 185(6), 2366-75. Nicotinamide inhibits growth of carcinogen induced mouse bladder tumor and human bladder tumor xenograft through up-regulation of RUNX3 and p300) 따라서 이러한 생화학적 과정과 추론이 틀리지 않다면, 동물에게 발암물질로 암을 유발하고 니코틴산아미드를 투여하면, 발암물질에 의한 동물의 암 발생이나 진행을 억제할 수 있어야 합니다.
3. 니코틴산아미드의 방광암 치료효과
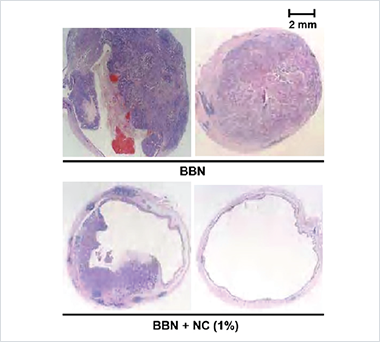
발암물질인 BBN을 투여하면 동물은 방광암을 유발하게 됩니다. 다음 사진들은 암 억제 유전자 RUNX3를 활성화하는 니코틴산아미드가 발암물질에 의한 방광암의 성장을 효과적으로 억제함을 보여주는 결과입니다.
발암물질인 BBN만 투여하고 니코틴산아미드를 투여하지 않은 생쥐의 방광암은 위쪽의 사진들과 같이 크지만(오른쪽 위 사진 – 암이 방광 전체를 꽉 채우고 있는 모습), 발암물질과 더불어 니코틴산아미드를 투여한 생쥐의 암은 아래쪽 사진들과 같이 작거나 또는 보이지 않습니다. (오른쪽 아래 사진 – 암이 거의 자라지 않은 모습).

다음 그림은 니코틴산아미드의 용량에 따른 암 성장 억제 효과를 보여주고 있습니다.
니코틴산아미드의 투여량이 0, 0.1, 0.25, 0.5, 1%로 증가할수록 방광암의 부피가 점점 더 작아지는, 확실한 방광암 억제 효과를 보여주고 있습니다.
(Kim et al. J Urol. 2011. 185(6):2366-75. Nicotinamide inhibits growth of carcinogen induced mouse bladder tumor and human bladder tumor xenograft through up-regulation of RUNX3 and p300)
4. 니코틴산아미드의 방광암 임상시험
여러 암에의 효과가 확인된 후, 셀가디언은 니코틴산아미드의 용도특허를 받아 (대한민국특허 제 1-00775549호, 출원일 2005년 5월 12일, 등록일 2007년 11월 5일, 특허권자 (주)셀가디언, 발명의 명칭: 나이아신아마이드 또는 그 유도체를 유효한 성분으로 포함하는 암 예방 및 치료제) 암 치료제로 개발하고자 표재성 방광암의 임상시험을 실시하였습니다. 표재성 방광암은 방광경을 이용하여 암 조직을 긁어내는 수술을 합니다.
그러나 아무리 수술을 잘해도 암세포를 최후의 하나까지 완전히 긁어내기가 어려워, 수술만 할 경우 수술 1년 후의 재발률이 약 45% 정도에 이릅니다. 그래서 1980년대 후반부터 표재성 방광암을 수술하고 나면 BCG(결핵 예방주사에 쓰이는 약독화 결핵균)를 방광에 반복 주입하는 방법이 시도되어 왔으며, 환자에게 고통스럽긴 하지만 이 BCG 추가 시술에 의해 방광암의 1년까지의 재발률은 약 25~30% 정도로 낮아지는 것으로 알려져 있습니다.
(M. Takashi et al. Int. Urol. Nephrol. 2002, 34: 329-334, Evaluation of multiple recurrence events in superficial bladder cancer patients treated with intravesicular bacillus Calmette-Guerin therapy using the Anderson-Gill’s model)
다음의 그림은 BCG 시술군과 니코틴산아미드 2000mg, 1000mg, 500mg 투여군과의 비교 임상시험 결과 (2007년~2009년, 임상시험번호 Amina-X-001, 총 환자 수 91명), 각 시점에서의 재발률을 꺾은선 그래프로 나타낸 것입니다.
점선의 ‘수술만 한 경우’는 BCG 시술에 의한 효과가 알려지기 전의 표재성 방광암의 수술 후 재발률을 문헌에서 찾아 추정한 추정 재발률입니다.
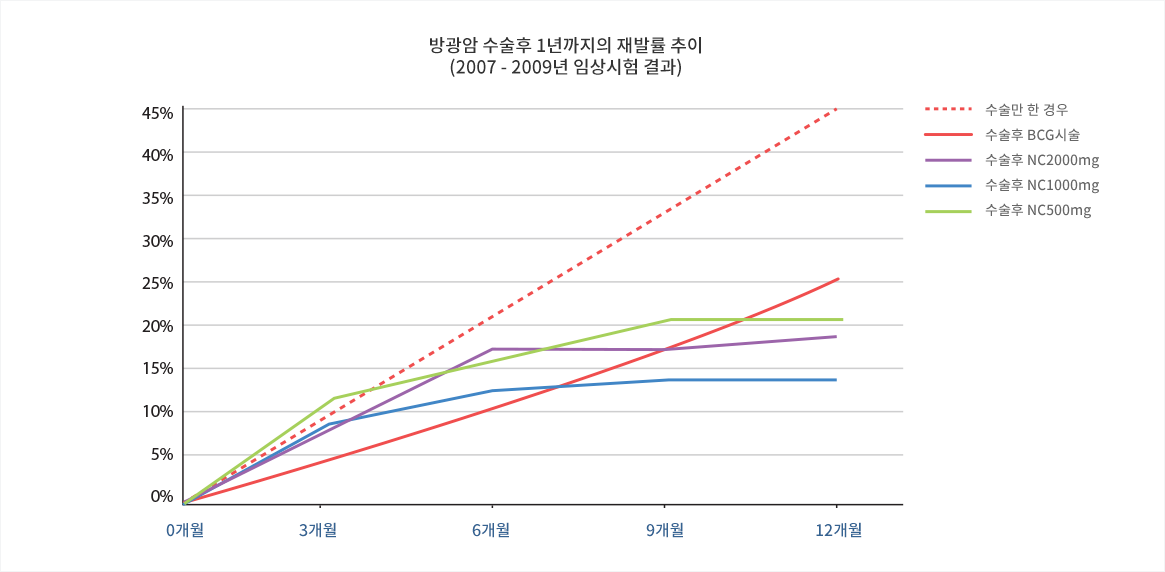
그림에서 보이듯 니코틴산아미드는 3개월~6개월의 초기에는 BCG 처치보다 조금 낮은 효과를 보이나, 9개월~12개월의 후기에는 비슷하거나 또는 조금 더 좋은 효과를 보이고 있습니다.
표본수가 적어 단언할 수는 없으나 무엇보다도 고무적인 것은 니코틴산아미드를 투여한 경우 모든 용량에서 재발률의 기울기가 시간이 지남에 따라 더욱 낮아지고 있다는 것입니다.
재발률의 기울기가 위의 점선이나 붉은 실선과 같이 일정하면 시간이 지나면 대부분의 환자들이 언젠가 결국은 다시 재발할 수 있음을 뜻하는데, 재발률의 기울기가 시간이 지남에 따라 낮아진다면 어느 시점에는 기울기가 수평에 이를 수도 있는 것이고, 그렇게 된다면 수평에 이른 시점에서 재발하지 않은 환자들은 아무리 시간이 지나도 ‘다시는 재발하지 않을 수 있음’을 뜻하기 때문입니다.
재발률의 기울기 변화에 대한 기대가 표본수가 충분치 않은 시험결과에서 오는 불확실한 예측이라 하더라도, 12개월 후의 결과를 보면 니코틴산아미드는 고통스러운 BCG 시술에 비하여 조금 우수하거나 최소한 대등합니다. 또한 이는 수술 후 아무것도 처치하지 않은 환자에서는 1년 후 100명 중 약 45명이 재발하는데 비하여, 수술 후 니코틴산아미드를 투여하면 100명 중 약 20명의 환자만이 재발함을 보여주고 있음으로써, hazard ratio(위험비) 0.37의 결과, 즉 니코틴산아미드 투여에 의해 환자는 63%의 위험율의 감소를 얻을 수 있다는 결과를 보여주고 있습니다.
그러나 안타깝게도 셀가디언의 임상시험 경험이 부족하다 보니 임상시험 설계 당시 대조군 설정과 표본수 산정을 잘못하는 바람에, 임상계획서상의 통계 설정값에 대한 유의성을 확보하지 못하였고 따라서 허가 과정으로 진행하지 못했습니다. 하지만 2007년-2009년 시행된 방광암 임상시험은 니코틴산아미드가 사람에서도 유효하며, 투여하지 않은 경우에 비하여 니코틴산아미드를 투여하면 암 환자의 재발(또는 진행)의 위험율을 약 60%가량 낮추어줄 수 있다는 중요한 결론을 셀가디언에 남겨주었습니다.
5. 니코틴산아미드의 간암 치료효과
간암에의 효과 (동물실험)
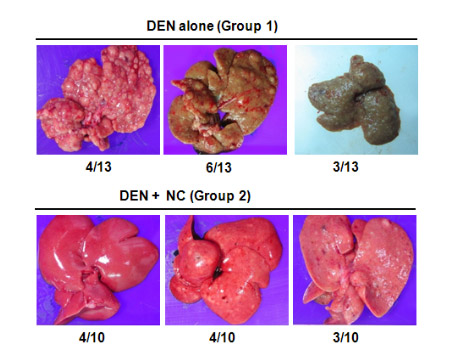
DEN은 간암을 유발하는 발암물질입니다. 다음 사진은 니코틴산아미드가 DEN에 의한 간암 발병을 효과적으로 억제함을 보여주는 결과입니다. 발암물질만을 투여한 군(group 1)과 발암물질 투여 후 니코틴산아미드를 투여한 군(group 2)의 42주 후의 간의 상태를 비교해 보았습니다. 발암물질을 투여하고 니코틴산아미드를 투여하지 않은 생쥐에서는 왼쪽의 사진들처럼 간에 암이 심각하게 진행되었지만(group 1), 발암물질에 더불어 니코틴산아미드를 투여하면 아래쪽 사진들이 보여주듯 간암의 진행이 효과적으로 억제되고 있음을 알 수 있습니다.(group 2) (Park et al., J Cell Physiol. 2012, 227(3): 899-908. Nicotinamide inhibits the early stage of carcinogen-induced hepatocarcinogenesis in mice and suppresses human hepatocellular carcinoma cell growth)
6. 니코틴산아미드의 장단점
우리나라에서 가족이나 친척, 또는 가까운 친구가 암으로 고통받는 아픔을 겪어보지 않은 사람은 거의 없을 것입니다. 셀가디언의 연구진도 마찬가지입니다. 임상시험이 허가 과정으로 진행하지 못한 결과로 인한 타격은 셀가디언이 가장 크게 입었지만,
1) 환자의 재발(또는 진행) 위험율을 약 60%가량 낮출 수 있고,
2) 부작용이 거의 없으며,
3) 비용도 대단히 저렴한즉, 환자와 가족을 경제적으로나 육체적으로 힘들게 하지 않으면서 효과를 보이는 안전한 물질을 항암(보조)제로 진입시키지 못함으로써, 하루라도 빨리 좋은 약이 나오기를 바라는 환자와 가족들에게도 송구스런 결과가 되었습니다.
최근 들어 셀가디언의 연구진이 아닌 세계의 다른 연구진에서도 니코틴산아미드의 작용점으로 생각되는 class III HDAC을 억제함으로써 일어나는 효과를 속속 발표하고 있으며, class III HDAC을 억제하면 또 다른 유명한 암 억제 유전자인 p53과 기타 정상세포를 지키고 암화를 막는 여러 유전자들의 활성을 향상시킨다고 보고하고 있습니다.
(B. Peck et al. Mol. Cancer Ther. 2010, 9(4): 844-855, SIRT inhibitors induce cell death and p53 acetylation through targeting both SIRT1 and SIRT2; H. Yamaguchi et al. J. Biol. Chem. 284(17): 11171-11183, p53 acetylation is crucial for its transcription-independent proapoptotic functions) 따라서 니코틴산아미드는 RUNX3 이외에도 p53 등 여러 암 억제 기구를 활성화시키는데 도움이 될 것으로 생각되며, 종양의 발생을 완전히 막지는 못하지만 실험 결과 초기의 양성종양이 악성종양으로 발전하는 과정을 억제하므로 암의 예방에도 효과가 있을 것으로 기대됩니다.
니코틴산아미드는 비타민이지만, 비타민이 몸에 좋으니 다량 투여하면 암에도 좋을 것이라든가 하는 불확실한 추론으로부터 출발한 물질이 아닙니다. 셀가디언의 연구진이 암 억제 유전자의 활성화를 과학적으로 추적하며 발견한 ‘안전한 물질’이 하필 비타민이었던 것입니다.
니코틴산아미드의 무엇보다의 장점은 수용성 비타민이어서 투여 용량에서 인체에 무독하고 부작용이 거의 없다는 점입니다. 1일 3000mg까지는 인체에 안전한 것으로 보고되어 있으며, 방사선 치료의 감수성을 높이기 위하여 인체에 1일 9000mg까지 투여한 결과에서도 메스꺼움이 나타났을 뿐 다른 부작용이 거의 없었습니다.
(M. Knip et al. Diabetologia, 2000, 43: 1337-1345, Safety of high-dose nicotinamide: a review) 우리나라 식품의약품안전처에서도 건강식품 중 체내 에너지 생성에 필요한 영양소로서 일일 670mg까지의 섭취를 허용하고 있는 물질입니다. (http://www.foodnara.go.kr/hfoodi/ > 원료별 정보 > 영양소 > 8번 나이아신) 지난번 임상시험의 계획이 치밀하지 못했음을 거울삼아, 올해 (2013년) 7월경 폐암에 대한 임상시험을 다시 시행하기 위해 셀가디언의 연구진은 작년 (2012년) 가을부터 준비해 왔습니다.
그러던 중, 암환자 요양원을 운영하고 계시는 어느 목사님으로부터 아픈 권고를 받게 됩니다. “약이 언제 나오게 되느냐?” “임상시험에 3~4년이 걸리게 되니 항암(보조)제로서는 지금부터 약 4~5년 후가 될 것이다.” “효과가 있고 안전함을 알고 있다면, 지금 의학적으로 다른 방법이 없는 환자들은 당장 쓸 수 있도록 해주어야 한다. 4~5년 후는 지금 내가 모시고 있는 환자들 대부분이 이 세상에 없게 된다. 그분들은 하루가 아깝고 급한 사람들이다. 내일도 먼, 그런 분들에게 희망이 될 수 있는 약을 알고 있으면서도 기회를 주지 않는 것은 죄악이다…” 2013년 여름부터 폐암에 대한 임상시험을 다시 실시합니다.
7. 니코틴산아미드의 폐암 치료효과(동물실험)
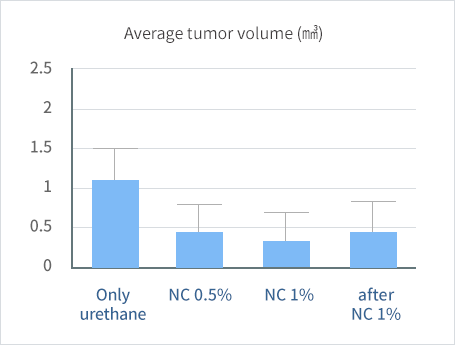
Urethane은 폐에 선암을 유발하는 발암물질입니다. 다음 그림은 니코틴산아미드가 urethane에 의한 폐암 발병을 효과적으로 억제함을 보여주는 결과입니다. 생쥐에 발암물질을 투여한 후, 니코틴산아미드를 투여한 군(NC 0.5%, NC 1%)과 그렇지 않은 군(only urethane)의 50주 후의 종양의 크기를 비교하였고, 암을 먼저 발생시킨 후 10주 후에 니코틴산아미드를 투여한 군(after NC 1%)과도 비교해 보았습니다. 발암물질만을 투여하고 니코틴산아미드를 투여하지 않은 생쥐에서는 암의 크기가 약 1.2 mm³ 정도이지만(왼쪽 막대 only urethane), 발암물질에 더불어 니코틴산아미드를 투여한 생쥐에서는 0.3-0.4 mm³ 정도의 크기로 암이 현저히 작아져 있음을 볼 수 있습니다(NC 0.5%, NC 1%). 한편 발암을 시킨 지 10주 후에 니코틴산아미드를 투여하기 시작한 경우에도(after NC 1%), 종양의 크기는 약 0.45 mm³ 정도로서 암의 성장이 효과적으로 억제되고 있음을 볼 수 있습니다. (논문 투고 준비 중)
8. 니코틴산아미드의 폐암 치료 효능(임상시험:2015-2023)
그렇다면 니코틴산아미드는 인간의 암에도 항암 효능을 가지는 것일까? 이 질문에 대한 답은 ‘그렇다’ 입니다. 먼저 기존의 암치료 요법에 대한 보조제로서 니코틴산아미드의 효능을 살펴보겠습니다. 방사선 암 치료 요법은 다양한 암에 대한 치료법으로 광범위하게 적용되고 있지만 심각한 부작용을 동반하는 문제를 안고 있습니다. 그런데 고용량(하루 500mg)의 니코틴산아미드 복용에 의하여 방광암, 후두암, 폐암, 유방암 등의 다양한 암에 대한 방사선 치료요법의 부작용이 현저히 감소하고 치료 효과가 증진됨이 보고되었습니다 (Nikas et al. Biomolecules. 20;10(3):477. (2020); Bernier et al., Oncol. 52(2):149. (1999); Rojas et al. Int J Radiat Oncol Biol Phys. 15;34(2):357-65. (1996))
거의 모든 종류의 암에 있어서 수술 및 방사선 치료 후 암의 재발은 환자의 생명을 위협하는 심각한 문제입니다. 그러므로 재발 가능성을 감소시키기 위하여 수술 및 방사선 치료 후 항암 치료를 병행하는 경우가 많은데 이 경우 환자는 항암제의 부작용으로 고통을 받게 됩니다. 놀랍게도 니코틴산아미드의 장기 복용은 유방암 방사선 치료 후 재발 방지에도 탁월한 효과가 있음이 보고되었습니다 (Dell’Omo et al. Oncotarget. 17;10(53):5495-5496. 2019). 니코틴산아미드의 유방암 외 다른 암에 대한 방사선 치료 후 재발 방지 효과는 아직 보고된 바 없지만 이론적으로 유방암의 경우와 유사한 효과가 있을 것으로 예상되고 있습니다.
9. 표적 항암제의 한계
니코틴산아미드의 항암 효능이 가지는 의미를 이해하기 위해서는 현대 의학의 꽃이라 불리우는 표적항암제의 한계를 먼저 알 필요가 있습니다. 표적항암제는 암 발병의 원인이 되는 과도한 암유전자의 활성을 억제함으로써 암을 치료하고자 하는 약물입니다. 활성이 과도하게 증가한 암유전자가 “표적”인 것입니다. 이러한 표적항암제는 단기적 암치료에는 크게 성공하고 있지만 대부분의 경우에 있어서 두 가지 큰 문제점을 보이고 있습니다. 첫째는 환자가 감내하기 어려운 약물 부작용입니다. 이는 표적항암제의 표적이 되는 암유전자가 정상세포에서도 중요한 기능을 수행하고 있는데 이러한 기능까지 표적항암제에 의해 억제되기 때문입니다. 둘째는 거의 대부분의 표적항암제는 단기적 암치료 효과만 가질 뿐 장기적 치료 효과는 가지고 있지 못하다는 점입니다. 이는 표적항암제에 의한 항암 치료 후 암이 대단히 높은 확률로 재발하는 현상 때문인데 이러한 현상을 설명하는 다양한 이론이 존재하지만 널리 받아들여지는 이론은 아직 수립되지 못하고 있습니다. 최근 면역항암제는 이러한 부작용과 재발의 문제를 극복하기 위한 노력의 일환으로 활발히 개발되고 있지만 역시 유사한 문제점들을 안고 있습니다. 이러한 문제점들 때문에 근치적 절제가 불가능한 암에 있어 고전적인 세포독성 항암제에 더불어 최근 더 효과적인 분자적 표적항암제 및 면역항암제의 개발이 활발하게 이루어지고 있지만, 이 약제들의 평균 수명 연장 효과 및 사망 위험 감소 효과는 아직 만족스럽지 못한 단계입니다.
10. 니코틴산아미드에 의한 표적 항암제의 한계 극복
이러한 상황에서 최근 셀가디언이 지원한 국내 연구진이 니코틴산아미드의 항암 효능에 관한 획기적인 임상시험 연구결과를 발표하였습니다 (Hyung-Joo Oh et al., Clinical Cancer Research 30(8):1478-1487. 2024). 이 연구에서는 4기 폐암환자 110명을 대상으로 한 임상시험 (Amina-X 프로젝트)을 통하여 하루 니코틴산아미드 1그램의 경구투여로 표적항암제 치료를 받는 여성 암환자 또는 비흡연 암환자의 평균 생존기간을 1년 이상 추가로 연장할 수 있으며, 사망 위험은 약 절반으로 줄일 수 있음을 밝혔습니다. 부작용 없는 암치료법 연구에 있어서 기념비적 성과로 평가받게 될 논문의 표지를 아래에 제시하였습니다.

니코틴산아미드(나이아신아마이드의 다른 이름)의 항암효능 임상시험 결과를 보고한 논문 표지 (Clinical Cancer Research 30(8):1478-1487. (2024))
이 논문에 발표된 연구 결과 중 가장 중요한 결과를 간단히 소개하면 다음과 같습니다. 아래 그래프에서 빨간색 선은 여성 폐암 환자에게 표적항암제(이레사 또는 타세바)만 투여한 경우 생존 커브입니다 (평균 생존기간 약 30.1개월). 보라색 선은 여성 폐암 환자에게 표적항암제와 니코틴산아미드를 병용 투여한 경우 생존 커브입니다 (평균 생존기간 약 43.4개월). 표적항암제 치료를 받는 환자의 평균 생존기간이 비타민 B3의 병용투여에 의해 약 13.3개월 연장되었음을 보여주는 결과입니다. 이 그래프에서 특히 강조할 점은 니코틴산아미드에 의한 암환자의 사망위험 감소효과입니다. 표적항암제만 투여한 그룹 환자들의 5년 후 생존율은 10% 미만이었으나 니코틴산아미드를 병용 투여한 암환자의 5년 후 생존율은 30% 이상으로 증가하였습니다. 이러한 통계 분석 결과는 비타민 B3에 의해 암환자의 사망위험이 절반으로 감소하였다고 해석됩니다. 남녀를 포함한 비흡연자 그룹에서도 유사한 결과가 관찰되었습니다. 본 연구의 통계적 신뢰도는 99%입니다 (p value = 0.01).
니코틴산아미드(나이아신아마이드의 다른 이름)의 항암 보조효능을 보여주는 임상시험 연구결과
(OS = Overall survival; Nicotinamide=나이아신아마이드)
이러한 부작용 없이 암환자의 평균 생존기간을 1년 이상 연장하고 사망위험은 절반으로 감소시키는 니코틴산아미드의 기적 같은 항암 보조효능은 표적항암제가 가지고 있던 기존의 한계를 확실히 돌파한 것입니다.
11. 니코틴산아미드의 항암보조효과의 확대 적용 가능성
그렇다면 폐암 환자에서 관찰된 니코틴산아미드의 항암 보조효능을 다른 암의 항암치료에도 확대 적용할 수 있을까요? 이러한 질문에 분명한 대답을 얻기 위해서는 각각의 암에 대한 추가 임상시험이 수행되어야 하며 이러한 결과는 아마도 10년 후에나 얻을 수 있을 것입니다. 만약 현시점에서 이러한 질문에 대답을 얻고자 한다면 니코틴산아미드의 확대 적용 가능성이 대단히 크다고 추정할 수 있습니다. 그 근거는 니코틴산아미드의 부작용 없이 항암 보조효능을 가지는 원리가 암세포내에서 기능이 저하된 암억제유전자 RUNX3의 기능을 강화하기 때문이라는 점에서 찾을 수 있습니다 (Kim et al. J Urol. 185(6):2366-75. (2011)). RUNX3는 세포의 삶과 죽음의 운명을 결정하는 유전자로서 이 유전자의 기능이 저하되면 분열해서는 안되는 세포가 분열하고 죽어야 할 세포가 죽지 않게 되어 암이 발병하게 됩니다 (Lee et al., Nature Communications. 10(1):1897-1917. (2019)). 일단 암이 발병한 후에도 RUNX3 기능이 복원되면 세포는 올바른 삶과 죽음의 운명의 판정을 받게 되어 암세포만 선별적으로 사멸되게 됩니다. 그런데 RUNX3는 폐암뿐 아니라 위암, 대장암, 간암, 방광암, 췌장암, 유방암 등 다양한 암에서 기능이 저하되어 있습니다 (Ito and Bae., Nature Review Cancer. 15(2):81-95. (2015)). 그러므로 항암제의 효능을 강화할 수 있는 니코틴산아미드의 항암 보조효과는 RUNX3 기능이 저하된 이러한 다양한 암에 폭넓게 적용될 수 있을 것으로 기대할 수 있습니다.
12. 니코틴산아미드의 암 예방 효능(임상 시험)
이상에 기술한 바와 같이 니코틴산아미드는 부작용 없이 항암 활성을 가지므로 암에 걸리기 전에 미리 니코틴산아미드를 복용하면 암을 예방할 수 있을 것으로 예상할 수 있습니다. 그러나 실제로 특정 물질을 복용하여 인간의 암을 예방할 수 있는지는 임상 시험을 통하지 않고는 확신할 수 없는 일입니다.
특히 암의 예방 효과를 확인하고자 하는 임상시험은 수많은 정상인이 암에 걸릴 때까지 장기간 추적해야 하므로 현실적으로 대단히 어려운 일입니다. 이러한 이유 때문에 암 예방 효과가 있을 것으로 기대되는 다양한 비타민에 대한 본격적인 임상시험이 진행되지 못하고 있는 실정입니다. 그런데 암 예방에 대한 임상시험이 가능한 암이 단 하나 있는데 이것은 피부암입니다. 대부분의 피부암은 피부염으로 시작하여 피부암으로 발전하게 되는데 피부염 환자를 모집하여 육안으로 관찰된 피부염이 약물투여에 의해 피부암으로의 발전이 억제되는지를 관찰함으로써 피부암 예방 효과에 대한 임상 시험을 할 수 있기 때문입니다.
최근 오스트레일리아의 한 그룹은 수백 명을 대상으로 한 3상 피부암 예방 임상시험에서 하루 500~1000mg의 니코틴산아미드의 복용으로 약 25~30%의 피부암 예방 효과를 거둘 수 있음을 증명하고 이러한 임상시험 결과를 최고 권위 의학 학술지 New England Journal of Medicine (NEJM)에 발표하였습니다 (Chen et al. N Engl J Med. 22;373(17):1618-26. (2015)).
세간에는 암을 예방할 수 있는 천연물이나 약물들이 이미 많이 개발되어 있다고 알려져 있는데, 이들의 암 예방 효능이 임상시험으로 확인된 것은 아닙니다. 이러한 물질들을 인간에게 적용할 때 어느 용량에서 어느 정도 효과가 있는지 그리고 그 용량에서 부작용은 없는지에 대한 연구는 대단히 빈약한 실정입니다. 일반적으로 천연물은 부작용 없이 안전하다고 생각되는 경향이 있지만 독약 중에도 천연물에서 얻어진 물질이 많으며 대부분의 천연물도 장기간 고용량을 복용하면 부작용을 보이게 됩니다. 게다가 예방제의 경우는 효능보다 부작용의 문제가 더욱 중요합니다. 예방을 위해 복용한 약 때문에 병을 얻어서는 안 되기 때문입니다. 즉, 암 예방 물질이 연구 수준에서는 많이 개발되어 있지만 현재 암 예방 효과가 임상시험으로 증명된 물질은 니코틴산아미드가 유일합니다. 암 예방 연구에 있어서 기념비적 성과로 평가받게 될 논문의 표지를 아래에 제시하였습니다.

Nicotinamide(나이아신아마이드의 다른 명칭)의 암 예방 효능 임상시험 결과를 보고한 논문 표지
비록 피부암 하나에서만 임상시험이 수행되었지만 니코틴산아미드의 암 예방 효과는 피부암뿐 아니라 방광암, 간암, 폐암, 소장암 등 다양한 모델의 동물실험에서 수십 편의 논문으로 보고되어 있습니다. 그러므로 니코틴산아미드의 암 예방 효과는 피부암뿐 아니라 다양한 암에 폭넓게 적용될 수 있음을 예상할 수 있습니다. 비타민의 일종인 니코틴산아미드의 복용으로 암에 걸릴 확률을 1/4 이상 감소시킬 수 있다는 최신 임상시험 결과는 암으로부터 조금이라도 멀어지고 싶은 현대인에게 가장 반갑고도 놀라운 뉴스일 것입니다.
암은 치유될 수 있습니다
암은 치유될 수 있습니다. 희망을 버리지 마십시오.
다음 그림은 영국의 Cancer Research UK(암연구소)에서 2010년까지의 자료를 바탕으로 발표한, 영국 환자의 각종 암의 10년 생존율 변화 추이입니다 (10년 생존이란 뜻은, 암이 나았든지, 아니면 암 조직이 아직 잔존하고 있다 해도 더 이상 진행하지 않고 환자의 생명을 위협하지 않는 상태입니다.)
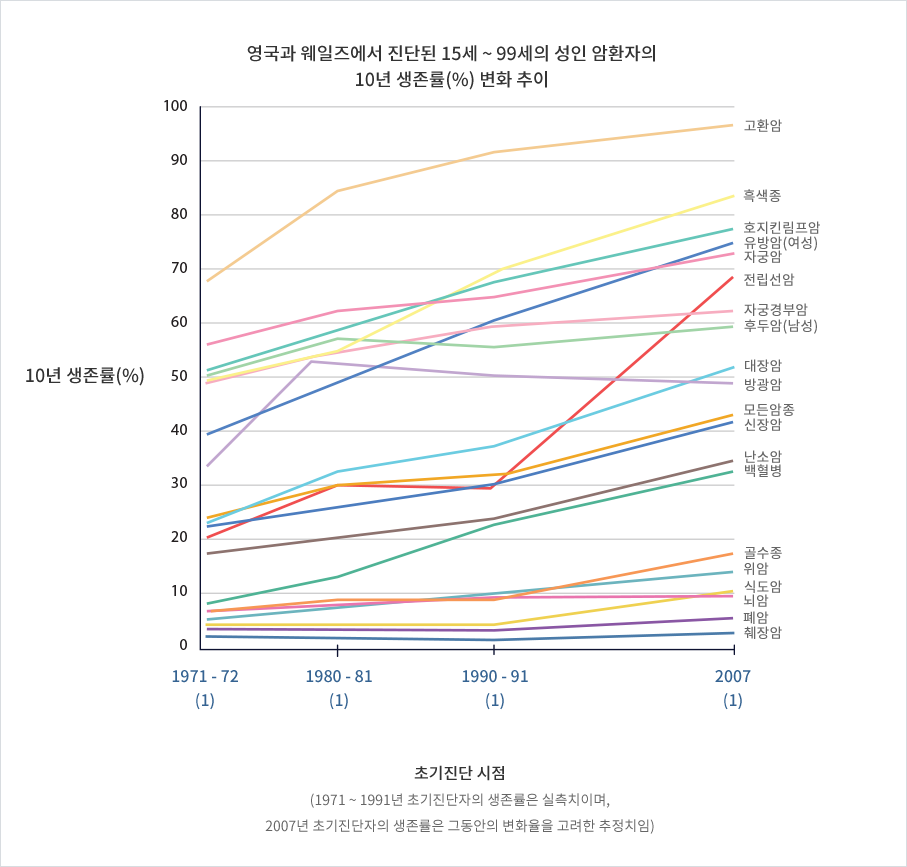
각종 암 환자의 10년 생존률이 점차 증가하는 것을 볼 수 있으며, 2007년 진단자의 10년 생존률 추정값은 전체 암(모든 암종)의 경우 45.2%에 이릅니다.
추정값이 아닌 1990-91년 진단자의 실측값도 33.7%나 됩니다.(http://www.cancerresearchuk.org/cancer-info/cancerstats/survival/latestrates/)
암종에 따라 뇌암, 폐암, 췌장암 등의 어려운 암도 있습니다. 그러나 이들의 10년 생존률도 점차 증가하고 있으며, 설령 매우 어려운 폐암의 10년 생존률이 현재 5.3%밖에 되지 않는다 하더라도 내게 맞는 약이나 치료법을 찾게 되면 내가 바로 그 5.3% 안에 들 수도 있으며, 그런 경우 ‘나’는 치유될 수 있는 것입니다.
의료진과 협의하여 내게 맞는 가장 좋은 길을 찾으십시오.
목표가 있어야 조금이라도 갈 수 있고, 포기하지 않아야 기회가 생깁니다.
셀가디언의 연구진은 우리나라 암 환자들의 10년 생존률을 단 몇 %라도 증가시키기 위하여 최선의 노력을 다할 것입니다.
이 글의 전문 용어는 가능한 한 풀어 쓰려고 노력하였으나 그래도 이해되기 어려운 부분이 있을 수 있습니다.
셀가디언의 항암 연구에 대하여 궁금하신 부분이 있으면 언제든지 문의해 주십시오.
감사합니다.
주식회사 셀가디언 연구진 일동